






《《常见的酸和碱》初三九年级化学PPT课件》是由用户上传到老师板报网,本为文库资料,大小为818 KB,总共有27页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 27页
- 818 KB
- VIP模板
- ppt
- 数字产品不支持退货
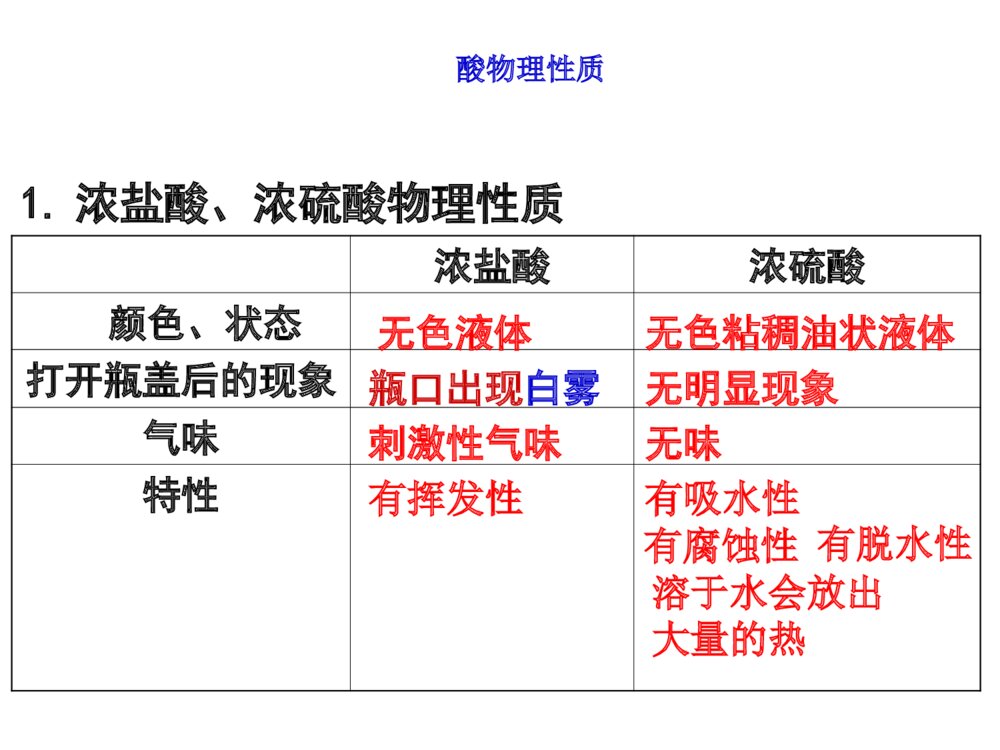
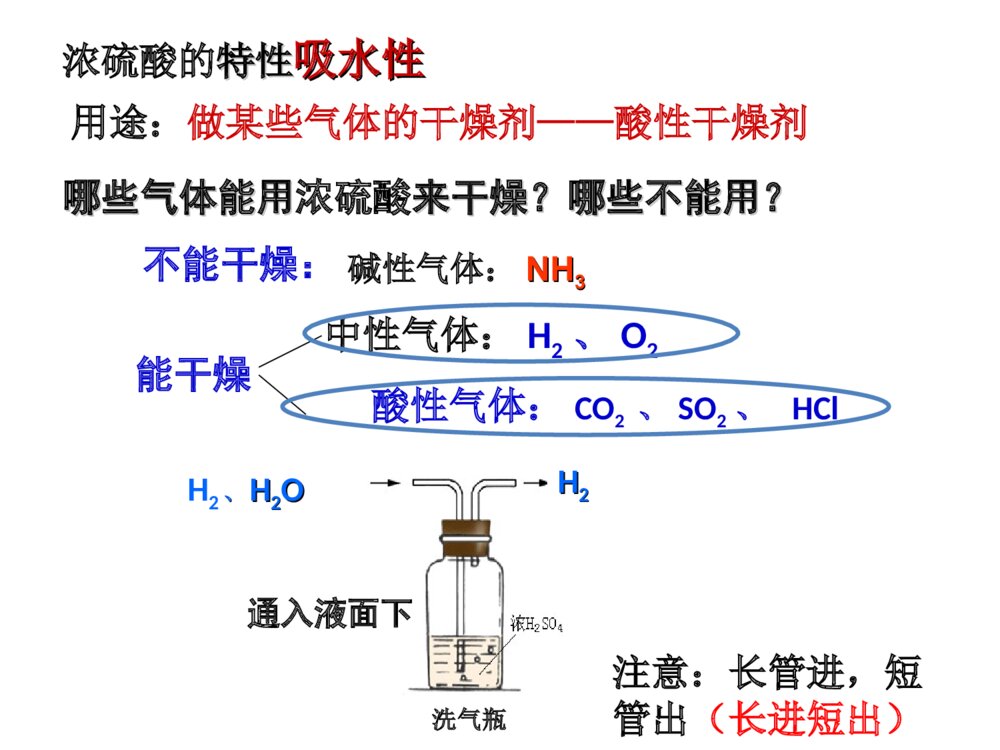
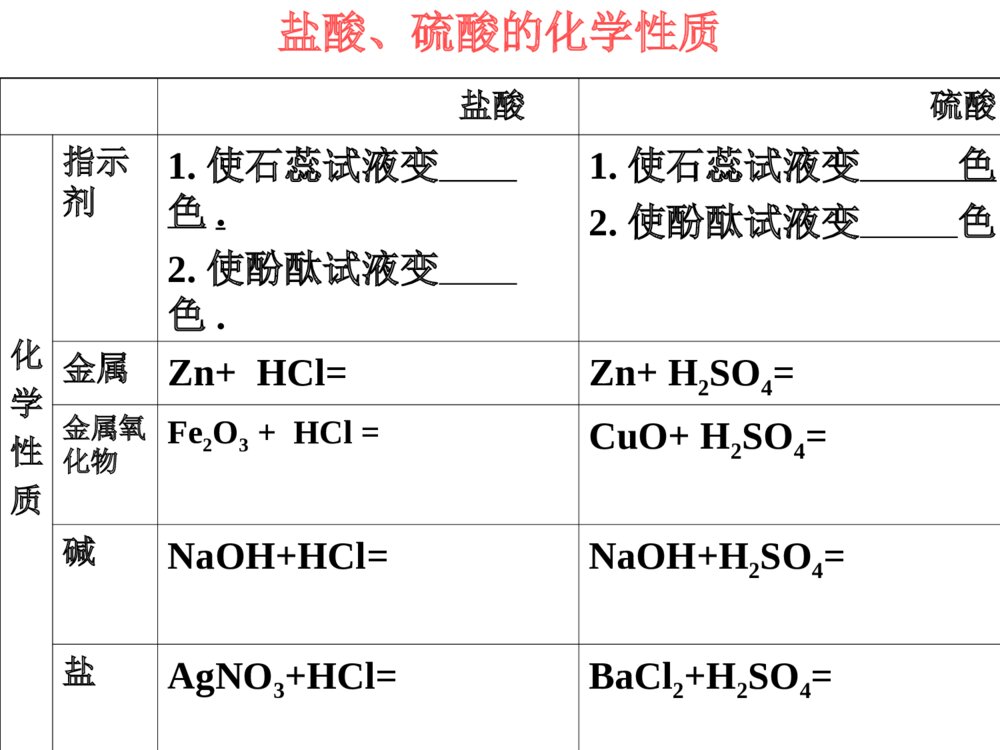
常见的酸和碱复习课大孔初级中学3.掌握酸和碱的通性及有关化学方程式1.掌握盐酸、硫酸的物理性质和化学性质2.掌握氢氧化钠、氢氧化钙物理和化学性质常考的知识点1、常见的酸:①浓盐酸、浓硫酸的特性(常考);②盐酸、稀硫酸的化学性质及有关的化学方程式(必考);③浓硫酸的稀释(常考)。2、常见的碱:①NaOH溶于水的放热现象(常考);②NaOH、Ca(OH)2在空气中变质的探究、生石灰作干燥剂变质的探究(常考);③运用碱的知识解释和处理生产、生活中的相关问题(必考)。3、溶液的酸碱性、pH及其应用:联系实际分析溶液的酸碱性、pH以及中和反应在工农业生产和医疗保健方面的应用(必考)。4、酸碱反应规律:酸碱性质的综合实验设计题(必考)1、什么叫酸?由氢离子和酸根离子构成的化合物叫酸.2、什么叫碱?由金属离子和氢氧根离子构成的化合物叫碱。思考问题:如:硫酸盐酸硝酸.碳酸醋酸.如:氢氧化钠氢氧化钙.氢氧化钾H2SO4HClHNO3H2CO3CH3COOHNaOHCa(OH)2KOH浓盐酸浓硫酸颜色、状态打开瓶盖后的现象气味特性无色液体瓶口出现白雾刺激性气味无色粘稠油状液体无明显现象无味有挥发性有吸水性1.浓盐酸、浓硫酸物理性质有脱水性有腐蚀性酸物理性质溶于水会放出大量的热师德师风学习心得体会分享【优秀】XX作为一名人民教师,要诚信立教,即淡泊名利,敬业爱生,在为人处事上少一点名利之心,在教书育人方面多一点博爱之心;创新施教,即以人为本,因材施教,同时要不断加强学习,与时俱进,学习先进的教学理念和方法,更新教育观念,掌握先进的教学技术和手段。“教书育人,教书者必先学为人师,育人者必先行为示范”。陶行知先生说过:“学高为师,德高为范。”说的都是为师者不仅要有广博的知识,更要有高尚的师德。优良的师德、高尚的师风是搞好教育的灵魂。通过此次师德师风教育学习,我简单得谈谈以下几点体会:教师应重视自身的道德形象,追求人格完美,重视教师职业的特质修养和个性魅力,有更高的人文目标。教师的一言一行,都无时无刻不在影响着学生,教育着学生。当我们的老师用自己的行动给学生作出表率时,也同时给学生指明了行动的方向。教师要严格要求自己,自觉遵守学校的规章制度和有关规定,以身作则,洁身自好,以德服人,以身立教,为学生树立起楷模的形象。教师要具有高度的工作责任感。一名称职的教师要以对社会、对家长、对学生高度负责的精神,努力做好教书育人过程中每个环节的工作。教育的神圣还在于在我们塑造学浓硫酸的特性特性吸水性吸水性用途:做某些气体的干燥剂——酸性干燥剂通入液面下H2、、HH22OOHH22哪些气体能用哪些气体能用浓硫酸来干燥?哪些不能用?来干燥?哪些不能用?注意:长管进,短管出(长进短出)洗气瓶能干燥不能干燥:碱性气体:NHNH33中性气体:H2、O2酸性气体:CO2、SO2、HCl从浓盐酸挥发出来的氯化氢气体跟空从浓盐酸挥发出来的氯化氢气体跟空气中的水蒸气接触形成盐酸小液滴气中的水蒸气接触形成盐酸小液滴..问题:1.浓盐酸瓶口为什么有白雾?浓盐酸特性:挥发性2.分别盛放浓盐酸和浓硫酸的两个试剂瓶,敞口放置一段时间后(不考虑水分的蒸发),两瓶酸的质量、质量分数各有何变化?溶质质量溶剂质量溶质质量分数浓盐酸浓硫酸减少减小增加减小不变不变密封保存应如何保存?盐酸、硫酸的化学性质盐酸硫酸化学性质指示剂1.使石蕊试液变色.2.使酚酞试液变色.1.使石蕊试液变色.2.使酚酞试液变色.金属Zn+HCl=Zn+H2SO4=金属氧化物Fe2O3+HCl=CuO+H2SO4=碱NaOH+HCl=NaOH+H2SO4=盐AgNO3+HCl=BaCl2+H2SO4=指示剂1.使石蕊试液变色.2.使酚酞试液变色.1.使石蕊试液变色.2.使酚酞试液变色.金属Zn+2HCl=ZnCl2+H2↑Zn+H2SO4=ZnSO4+H2↑金属氧化物Fe2O3+6HCl=2FeCl3+3H2OCuO+H2SO4=CuSO4+H2O碱NaOH+HCl=NaCl+H2O2NaOH+H2SO4=Na2SO4+2H2O盐AgNO3+HCl=AgCl↓+HNO3BaCl2+H2SO4=BaSO4↓+2HCl红红无无无无1.能使指示剂变色2.酸+金属=盐+氢气3.酸+金属氧化物=盐+水4.酸+碱=盐+水(中和反应)5.酸+盐=新酸+新盐酸能使石蕊变红,不能使酚酞变色条件:(1)金属指排在H前面的活泼金属Zn+H2SO4=ZnSO4+H2↑Fe+H2SO4=FeSO4+H2↑CuO+H2SO4=CuSO4+H2OFe2O3+6HCl=2FeCl3+3H2ONaOH+HCl=NaCl+H2OCu(OH)2+H2SO4=CuSO4+2H2O条件:生成物中有↑或↓或水AgNO3+HCl=AgCl↓+HNO3Ba(NO3)2+H2SO4=BaSO4↓+2HNO3CaCO3+2HCl=CaCl2+H2O+CO2↑酸的通性练习---直击中考1、下列物质与稀硫酸混合不能产生氢气的是()A:镁B:银C:铁D:铝B根据金属活动性顺序表知道:镁>铝>铁>(氢)>银银排在氢之后,所以它不能和稀硫酸反应.2、“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后再加热,溶液颜色的变化是( )A.先变蓝后变紫B.变红后颜色不再改变C.先变无色后变红 D.先变红后变紫D3、苯甲酸(C6H5COOH)可用作食品防腐剂,其酸性比醋酸强,下列对苯甲酸性质的推测,不合理的是()A、苯甲酸能使石蕊试液变红色B、苯甲酸不能使酚酞变色C、苯甲酸溶液的pH>7D、苯甲酸溶液的pH<7C名称氢氧化钠氢氧化钙化学式俗名颜色、状态溶解性露置在空气中的现象火碱、烧碱、苛性钠熟石灰、消石灰白色固体白色固体易溶,溶解时放出大量的热微溶易吸水而潮解,可做干燥剂无明显现象NaOHCa(OH)21.常见碱的物理性质氢氧化钠、氢氧化钙的性质的比较指示剂非金属氧化物酸盐溶液使石蕊试液变——色使酚酞试液变——色使石蕊试液变——色使酚酞试液变——色2.常见碱的化学性质:CO2+NaOH=CO2+Ca(OH)2=NaOH+HCl=Ca(OH)2+HCl=CuSO4+NaOH=Na2CO3+Ca(OH)2------指示剂非金属氧化物酸盐溶液使石蕊试液变——色,使酚酞试液变——色蓝红使石蕊试液变——色使酚酞试液变——色蓝红CO2+2NaOH=Na2CO3+H2OCO2+Ca(OH)2=CaCO3↓+H2ONaOH+HCl=NaCl+H2OCa(OH)2+2HCl=CaCl2+2H2OCuSO4+2NaOH=Cu(OH)2↓+Na2SO4Na2CO3+Ca(OH)2=2NaOH+CaCO3↓1.能使指示剂变色2.碱+非金属氧化物=盐+水3.碱+酸=盐+水(中和反应)4.碱+盐=新碱+新盐CO2+Ca(OH)2=CaCO3↓+H2OCO2+2NaOH=Na2CO3+H2OSO2+2NaOH=Na2SO3+H2O条件:(1)生成物中有↑或↓或水(2)反应物均可溶CuSO4+2NaOH=Cu(OH)2↓+Na2SO4Ca(OH)2+Na2CO3=CaCO3↓+2NaOHFeCl3+3NaOH=Fe(OH)3↓+3NaClNH4NO3+NaOH=NH3↑+H2O+NaNO3使紫色的石蕊试液变—蓝—色,使无色的酚酞试液变—红—色NaOH+HCl=NaCl+H2OCu(OH)2+H2SO4=CuSO4+2H2O碱的通性成份:氢氧化铝、碘甲基蛋氨酸等3HCl+Al(OH)3==AlCl3+3H2O用化学方程式表示斯达舒治疗胃酸过多症的原理:练习---直击中考1、把纯水、稀硫酸和氢氧化钠三种无色溶液区别开的最简单的方法是()A:滴入酚酞试液B:滴入石蕊试液C:滴入氯化钡溶液D:通入二氧化碳气体B2、在氯化铁溶液中滴入烧碱溶液,观察到的现象是()A:有白色沉淀B:有红褐色沉淀C:有气泡冒出D:有蓝色沉淀产生BFeCl3+3NaOH===Fe(OH)3↓+3NaCl红褐色提示:3、填空氢氧化钠又名苛性钠,这是因为它有强烈的_________。氢氧化钠必须密封保存,是因为它能吸收空气中的_____,并能跟空气中_____________起反应。腐蚀性水分二氧化碳2NaOH+CO2===Na2CO3+H2O酸→H++酸根离子4、“物质的组成与结构决定物质的性质”是化学学科中的重要观点。按照这一观点讨论:酸溶液具有一些共同的化学性质,是因为酸溶液中都含有;碱溶液也具有一些共同的化学性质,是因为碱溶液中都含有。碱→金属离子+OH-H+OH-5.向装有一定量Ba(OH)2溶液的小烧杯中,不断慢慢滴入稀H2SO4至过量,有关溶液pH和滴入稀H2SO4体积的变化情况如下图所示,其中正确的是()D小明看见爸爸常常用稀盐酸给铁制器皿除锈,他自己想亲自试一试。于是,他找出一颗生锈铁钉出来,放入足量稀盐酸中,然后,美滋滋地去睡觉了……可是,当他醒来之后,发现铁钉不见了,你知道为什么吗?用两个化学方程式表示出来。生锈铁钉消失的原因1、Fe2O3+6HCl==2FeCl3+3H2O2、 Fe+2HCl==FeCl2+H2↑铁锈溶解铁溶解溶解完全小结:一、浓盐酸、浓硫酸的物理性质及特性二、酸的化学通性三、常见碱的物理性质及化学通性



















